A resistência aos antimicrobianos está disseminada pelos diferentes continentes e representa uma grande ameaça à saúde pública global, sendo considerada uma pandemia silenciosa em curso, mesmo antes da emergência da doença do coronavírus 2019 (COVID-19). Na vigência desta, uma atenção maior tem sido despertada junto a profissionais de saúde e autoridades públicas quanto ao futuro pós-pandêmico. Com que intensidade a pandemia de COVID-19 irá agravar a emergência e disseminação de microrganismos resistentes aos antimicrobianos? Esta preocupação se estende tanto para um possível aumento na ocorrência de bactérias resistentes aos antimicrobianos, quanto para o impacto nos ecossistemas pela grande quantidade dessas drogas sendo despejada livremente no meio ambiente.
Com o intuito de auxiliar no estabelecimento de protocolos mais adequados, que minimizem o uso inadequado de antimicrobianos, a Organização Mundial da Saúde (OMS) disponibilizou um guia para tratamento da COVID-19 desencorajando o uso destes em casos suspeitos e leves, e recomendando que a antibioticoterapia empírica seja restrita aos pacientes graves em que haja evidências de infecção bacteriana (WHO, 2020). O guia também inclui o tratamento empírico para idosos residentes em casas de repouso e crianças menores de 5 anos com sintomas moderados.
O uso empírico de antibióticos na pandemia se sustenta no risco de coinfecções bacterianas. A coinfecção, frequentemente de etiologia bacteriana, se instala em pacientes já debilitados por outra infecção, comumente viral, que fragiliza as defesas imunes locais facilitando o estabelecimento de bactérias. Essa é uma preocupação muito comum em infecções causadas por vírus influenza, como o H1N1, em que as taxas de coinfecção podem chegar a 40% (MacIntyre et al 2018; Palacios et al 2009). Em casos de coronavírus, as taxas de coinfecção relatadas tem variado entre 5 a 8% (Lin et al 2020; Rawson et al 2020; Garcia-Vidal et al 2021). Há, no entanto ponderações sobre a possibilidade desses dados estarem sendo subestimados por conta de aspectos relacionados a dificuldades de adesão a protocolos de avaliação e diagnóstico etiológico sistemático das coinfecções, contribuindo para que este seja negligenciado.
Apesar dos relatos de taxas baixas de coinfecção, a prescrição de antibióticos no tratamento de COVID-19 tem sido alta. Segundo a Sermo (2020; uma rede privada de mídia social para profissionais da saúde licenciados nos Estados Unidos e em outros 149 países na Europa, América do Norte e do Sul, África e Oceania), que entrevistou 6227 médicos em todo o mundo, foi relatado que 41% destes profissionais receitaram azitromicina no tratamento de COVID-19. Em uma revisão de literatura, foi observado que, dos 2010 pacientes com COVID-19 incluídos nos estudos, 1450 (72%) receberam terapia antibacteriana, geralmente de amplo espectro, prescrita em ambientes de cuidados críticos e não críticos (Rawson et al 2021).
Um grande gargalo na tomada de decisão referente ao uso de antimicrobianos é diferenciar clinicamente a COVID-19 e a progressão para infecção bacteriana. Coinfecções bacterianas constituem uma das principais causas de agravamento e mortalidade no intercurso de infecções virais, podendo chegar a taxas de mortalidade 57,1% nos casos de COVID-19 (Soriano et al 2021). As estratégias para a correta diferenciação são limitadas, o que contribui para o uso desnecessário de antimicrobianos. Ainda assim, as coinfecções parecem estar relacionadas com cuidados intensivos e infecções relacionadas à assistência à saúde, comuns em ambiente hospitalar, não havendo evidências de aumento nas taxas de coinfecções atribuíveis diretamente a COVID-19.
Há evidências de que uma grande proporção de pacientes receberam antibioticoterapia mesmo sem complicações por coinfecção durante a pandemia em todo o mundo (Soriano et al 2021). Um dos principais exemplos é o uso da azitromicina, à qual, numa concepção equivocada, foram atribuída possíveis atuações como antiviral contra o coronavírus e fortalecedora do sistema imune, como forma de “tratamento precoce”, o que foi estimulado por meio de mídias divulgadoras de fakenews, a tal ponto dessa droga fazer parte do que foi popularmente chamado de “Kit-Covid”.
A literatura científica, no entanto, não deixa dúvidas quanto à ineficácia do uso desta droga como tratamento precoce ou terapêutico (Mitjá et al 2020). Em uma revisão reunindo 25 estudos observacionais sobre o uso de hidroxicloroquina, em associação ou não com azitromicina, e o impacto sobre a mortalidade de pacientes COVID-19, foi constatado que o uso apenas de hidroxicloroquina não foi associado a menor mortalidade e que a combinação entre este fármaco e azitromicina foi relacionado ao aumento na mortalidade por COVID-19 (Fiolet et al 2021). Num desses estudos foi demonstrado que a mortalidade em 21 dias foi de 22,5% com a combinação hidroxicloroquina e azitromicina, contra 17,8% de mortalidade quando nenhuma droga foi utilizada (Rosenberg et al 2020).
A constatação de que a pandemia de COVID-19 representa uma circunstância sem precedentes para o uso indiscriminado de antimicrobianos, tem feito com que a preocupação com os potenciais impactos seja redobrada. Isto é particularmente aplicável, sobretudo no que diz respeito ao impacto na área de terapia anti-infecciosa, visto que a disseminação de resistência aos antimicrobianos pode limitar ainda mais o arsenal disponível para uso no ambiente hospitalar, o qual já concentrava pacientes com infecções graves, frequentemente causadas por microrganismos resistentes, mesmo antes da pandemia de COVID-19.
O impacto ambiental também deve ser fortemente considerado neste cenário. O uso massivo de drogas na pandemia submete o meio ambiente a níveis de contaminação nunca antes expostos. Os antimicrobianos são eliminados através das fezes e pela urina, acumulando-se no ambiente. Dessa forma, o impacto ambiental pode ser amplo, desde exercendo pressão seletiva sobre a microbiota ambiental até o acúmulo em componentes da fauna e flora que possam vir a ser consumidos por animais e seres humanos.
Em relação a azitromicina, a EU Water Framework Directive estabelece uma concentração máxima de 5 μg/L e, em efluentes de tratamento de esgoto, entre 0,05 e 0,6μg/L (Rodriguez-Mozaz et al, 2020). Esta diretriz da União Europeia determina que os países membros do bloco alcancem bons índices qualitativos e quantitativos em todas as massas de água. Este antimicrobiano atua sobre vários microrganismos, inclusive cianobactérias, consideradas como um protetor capaz de minimizar o desenvolvimento de resistência a antimicrobianos no ambiente (Loos et al, 2018; Rodriguez-Mozaz et al, 2020; Tarazona et al 2021). Além disso, de acordo com as estimativas de Tarazona e colaboradores (2021), um risco ambiental potencial deve ser esperado se a taxa de uso for superior a 0,016% da população humana.
As atuais estratégias para controlar a resistência aos antimicrobianos podem sofrer os efeitos do uso massivo de antimicrobianos na pandemia de COVID-19. Além disso, as perspectivas se tornam ainda mais desoladoras, haja visto o contínuo declínio do investimento no desenvolvimento de novos antimicrobianos para uso clínico. A pandemia de microrganismos resistentes aos antimicrobianos é uma crise silenciosa, historicamente negligenciada, que agora demanda a atenção e a atuação crescente dos pesquisadores, dos órgãos de controle, e da população, em geral, no sentido de minimizar o impacto do ciclo da resistência (Figura 1).
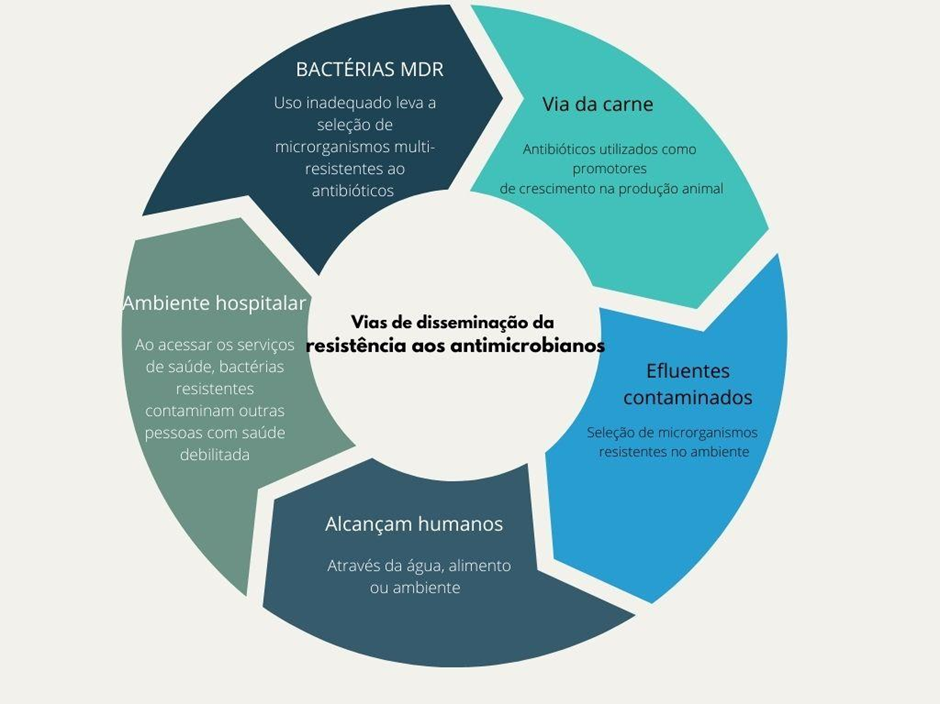
O cenário atual ressalta o fracasso em não prevenir e em não estar preparado para o possível surgimento de uma pandemia. Para além de todas as tragédias vivenciadas ao longo da pandemia de COVID-19, há lições vitais para aplicar na luta contra a resistência aos antimicrobianos. Os estudos de novas estratégias e tecnologias devem ser apoiados para que a prescrição de antimicrobianos possa ser mais bem fundamentada, como o uso de biomarcadores específicos para bactérias comumente relacionados à coinfecção. Não menos importante, incentivar a coleta de amostras microbiológicas adequadas antes do início da terapia é crucial para o uso criterioso de antimicrobianos (Ali et al 2019; Fontela et al 2018). Destaca-se também a importância das ações em medidas de saúde pública organizadas e em conjunto, além do apoio intensivo à pesquisa científica, a fim de dificultar o surgimento de microrganismos resistentes que poderiam levar a outras emergências de saúde pública.
Autores: Caroline Lopes Martini & Lúcia Martins Teixeira
Referências consultadas
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6396654/pdf/idr-12-493.pdf
https://www.clinicalmicrobiologyandinfection.com/action/showPdf?pii=S1198-743X%2820%2930505-X
https://www.clinicalmicrobiologyandinfection.com/action/showPdf?pii=S1198-743X%2820%2930450-X
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7089461/pdf/11427_2020_Article_1668.pdf
https://publications.jrc.ec.europa.eu/repository/handle/JRC111198
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7454406/pdf/ciaa1009.pdf
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7197596/pdf/ciaa530.pdf
https://www.clinicalmicrobiologyandinfection.com/action/showPdf?pii=S1198-743X%2820%2930577-2
https://jamanetwork.com/journals/jama/fullarticle/2766117
https://www.journalofinfection.com/article/S0163-4453(20)30594-6/fulltext
https://www.sciencedirect.com/science/article/abs/pii/S0048969721013255?via%3Dihub
https://www.who.int/publications-detail/clinical-management-of-covid-19 Acesso em 13/04/2021



0 comentário